เรื่องที่ 16 ปุ๋ยเคมีที่ให้ธาตุฟอสฟอรัส
30/04/2020บทความชุด “ดิน ธาตุอาหารและปุ๋ย” เพื่อ “เพิ่มผลผลิต”
เรื่องที่ 16 ปุ๋ยเคมีที่ให้ธาตุฟอสฟอรัส
รองศาสตราจารย์ ดร. ยงยุทธ โอสถสภา
ภาควิชาปฐพีวิทยา คณะเกษตร กำแพงแสน มหาวิทยาลัยเกษตรศาสตร์
1. คำนำ
ปุ๋ยฟอสเฟต (ปุ๋ยฟอสฟอรัส) คือ ปุ๋ยที่มีธาตุฟอสฟอรัสเป็นองค์ประกอบ ในปัจจุบันผลิตโดยการนำหินฟอสเฟตมาแปรสภาพด้วยกระบวนการทางเคมี เพื่อให้ฟอสฟอรัสที่เป็นองค์ประกอบในหินฟอสเฟต อยู่ในรูปที่ใช้ประโยชน์ง่าย
หินฟอสเฟต (phosphate rock) คือ หินซึ่งมีแร่อะพาไทต์ (apatite) เป็นองค์ประกอบสำคัญ และขุดได้จากแหล่งใต้ดิน (ภาพที่ 1) เป็นวัตถุดิบที่ใช้ในการผลิตปุ๋ยฟอสเฟตที่ละลายน้ำง่าย เริ่มจากการนำหินฟอสเฟตมาผลิตกรดฟอสฟอริก (H3PO4) ต่อจากนั้นจึงนำกรดฟอสฟอริกมาผลิตปุ๋ยฟอสเฟตชนิดชนิดต่างๆ เช่น โมโนแอมโมเนียมฟอสเฟต (MAP สูตร 11-55-0) ไดแอมโมเนียมฟอสเฟต (DAP สูตร 18-46-0) และทริปเปิลซูเปอร์ฟอสเฟต (สูตร 0-46-0) ในบทนี้จะอธิบายรายละเอียดเรื่องปุ๋ยไดแอมโมเนียมฟอสเฟต

ภาพที่ 1 การทำเหมืองหินฟอสเฟต เพื่อนำมาใช้เป็นวัตถุดิบในการผลิตปุ๋ยฟอสเฟต
2. การผลิตกรดฟอสฟอริก
กรดฟอสฟอริกผลิตได้จากปฏิกิริยาระหว่างหินฟอสเฟตบดกับกรดซัลฟิวริก (กรดกำมะถัน) ผลปฏิกิริยามี 2 อย่างคือ กรดฟอสฟอริก (H3PO4) ซึ่งเป็นของเหลว และยิปซัม (CaSO4.H2O) ซึ่งเป็นของแข็ง จึงแยกออกจากกันด้วยการกรอง (filtration) ดังภาพที่ 2
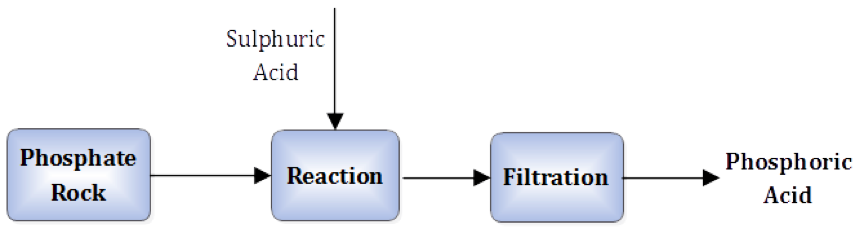
ภาพที่ 2 กระบวนการผลิตกรดฟอสฟอริก
3. การผลิตและสมบัติของปุ๋ยไดแอมโมนียมฟอสเฟต
3.1 การผลิต
ปุ๋ยไดแอมโมเนียมฟอสเฟต (diammonium phosphate, DAP) สูตร 18-46-0 ผลิตได้จากปฏิกิริยาระหว่างแอมโมเนีย (NH3) กับกรดฟอสฟอริก (H3PO4) ดังสมการ
2NH3 + H3PO4 ¾¾® (NH4)2HPO4
ปุ๋ยไดแอมโมเนียมฟอสเฟตมี 2 แบบคือ
1) ปุ๋ยรูปผลึก มีไนโตรเจนทั้งหมด 21 %N และ ฟอสเฟตที่เป็นประโยชน์ 52 %P2O5 ปุ๋ยประเภทนี้เหมาะสำหรับใช้ทางใบหรือใช้ร่วมกับระบบชลประทาน
2) ปุ๋ยชนิดเม็ด โดยทั่วไปมีสูตร 18-46-0 เหมาะสำหรับให้พืชทางดิน (ภาพที่ 5.10)

ภาพที่ 3 ปุ๋ยไดแอมโมเนียมฟอสเฟตสูตร 18-46-0
กระบวนการผลิตปุ๋ยไดแอมโมเนียมฟอสเฟตชนิดเม็ด สูตร 18-46-0 มี 3 ขั้นตอนดังนี้
1)ให้แอมโมเนียทำปฏิกิริยากับกรดฟอสฟอริกในถังทำให้เป็นกลางล่วงหน้า (preneutralizer) โดยกำหนดโมลเรโชของ NH3 : H3PO4 เท่ากับ 2:1 ได้ไดแอมโมเนียมฟอสเฟตเป็นของเหลวข้น
2).ส่งของเหลวเข้มข้นไปยังเครื่องปั้นเม็ด เพื่อแปรสภาพเป็นปุ๋ยชนิดเม็ด
3).ลดความชื้นด้วยการอบ คัดขนาดและลดอุณหภูมิ
3.2 สมบัติของปุ๋ย
สมบัติทางเคมีและสมบัติทางฟิสิกส์ของปุ๋ยไดแอมโมเนียมฟอสเฟตมีดังนี้
1) สมบัติทางเคมี
สมบัติทางเคมีที่สำคัญของปุ๋ยไดแอมโมเนียมฟอสเฟตมีดังนี้
(1) องค์ประกอบทางเคมี คือ (NH4)2HPO4 เมื่อเป็นสารเคมีบริสุทธิ์มีไนโตรเจนทั้งหมด 21.19%N และฟอสเฟตทั้งหมด 53.76%P2O5 ปุ๋ยเคมีชนิดเม็ดมีปริมาณธาตุอาหารรับรอง คือ มีไนโตรเจนทั้งหมด 18%N และฟอสเฟตทั้งหมด 46%P2O5
(2) เมื่อไดแอมโมเนียมฟอสเฟต 1 โมเลกุลละลายน้ำ จะแตกตัวให้แอมโมเนียมไอออน (NH4+) จำนวน 2 ไอออน และโมโนไฮโดรเจนฟอสเฟตไอออน (HPO42-) จำนวน 1 ไอออน
(3) สารละลาย 0.1 นอร์มาลของไดแอมโมเนียมฟอสเฟตมีค่าพีเอช 7.8
(4) เป็นปุ๋ยก่อกรด สภาพกรดสมมูล 74 ซึ่งหมายความกว่าหากไม่พิจารณาภาวะบัฟเฟอร์ของดินแล้ว สภาพกรดที่เกิดในดินจากปุ๋ย 100 กก.ต้องการแคลเซียมคาร์บอเนต 74 กก.ในการทำให้เป็นกลาง
2) สมบัติทางฟิสิกส์
สมบัติทางฟิสิกส์ที่สำคัญของปุ๋ยไดแอมโมเนียมฟอสเฟตเมื่อเป็นสารเคมีบริสุทธิ์มีดังนี้
(1) ความหนาแน่นอนุภาค 1.619 กรัม/ลูกบาศก์เซนติเมตร
(2) สภาพละลายน้ำจนถึงจุดอิ่มตัว 57.5 กรัม/น้ำ 100 มิลลิลิตรที่ 10 องศาเซลเซียส
4. ภาพรวมการเปลี่ยนแปลงของปุ๋ยไดแอมโมนียมฟอสเฟตในดิน
เมื่อใส่ปุ๋ยไดแอมโมเนียมฟอสเฟตชนิดเม็ดลงไปในดินจะมีการเปลี่ยนแปลง 3 แบบ
1) เม็ดปุ๋ยดูดความชื้นแล้วค่อยๆละลาย เกลือไดแอมโมเนียมฟอสเฟตอันเป็นองค์ประกอบของปุ๋ยจึงแตกตัวให้ แอมโมเนียมไอออนจำนวน 2 ไอออน และฟอสเฟตไอออนจำนวน 1 ไอออน
2) รากพืชดูดแอมโมเนียมไอออนและฟอสเฟตไอออน
(1) การดูดแอมโมเนียมไอออน พืชใช้โปรตีนขนส่งที่เยื่อหุ้มเซลล์สำหรับดูดแอมโมเนียมไอออนจากดิน เข้าไปในเซลล์
(2) การดูดฟอสเฟตไอออน เยื่อหุ้มเซลล์ของพืชมีโปรตีนพาหะ และช่องผ่านไอออน สำหรับการดูดฟอสเฟตไอออนจากดิน
3) ปฏิกิริยาของแอมโมเนียมไอออนและฟอสเฟตไอออนในดิน
(1) ปฏิกิริยาของแอมโมเนียมไอออนในดินที่รากพืชยังไม่ได้ดูดไปใช้และคงอยู่ในดิน จะทำปฏิกิริยากับดิน ดังรายละเอียดที่กล่าวแล้วในเรื่องปุ๋ยไนโตรเจน
(2) ปฏิกิริยาของฟอสเฟตไอออนในดิน ที่สำคัญคือ การตรึงฟอสฟอรัสหรือการตรึงฟอสเฟตของดิน
5. การตรึงฟอสเฟต
การตรึงฟอสฟอรัส เป็นปฏิกิริยาของฟอสเฟตไอออนกับองค์ประกอบของดิน ทำให้ฟอสเฟตไอออนซึ่งเป็นประโยชน์ กลายเป็นรูปที่ไม่เป็นประโยชน์ต่อพืช ปฏิกิริยาการตรึงมี 2 ส่วน คือ การดูดซับและการตกตะกอน ซึ่งขึ้นอยู่กับพีเอชของดินดังนี้
1) ในดินกรด: ฟอสเฟตไอออนทำปฏิกิริยากับเหล็กและอะลูมินัมกลายเป็นสารประกอบเหล็กฟอสเฟตและอะลูมินัมฟอสเฟตแล้วตกตะกอนเป็นแร่ทุติยภูมิ หรือฟอสเฟตไอออนดูดซับที่ผิวของอนุภาคเหล็กออกไซด์ อะลูมินัมออกไซด์และแร่ดินเหนียว
2) ในดินที่มีปฏิกิริยาเป็นกลาง เป็นด่าง หรือในดินเนื้อปูน: ฟอสเฟตไอออนตกตะกอนกลายเป็นแร่ทุติยภูมิ คือ แคลเซียมฟอสเฟต และแมกนีเซียมฟอสเฟต หรือฟอสเฟตไอออนดูดซับอย่างแข็งแรงที่ผิวแร่ดินเหนียวและแร่แคลไซต์
6. การปลดปล่อยฟอสเฟตออกมารักษาสมดุล
เมื่อความเข้มข้นของฟอสเฟตไอออนในสารละลายดินลดลงมาก เนื่องจากรากพืชและจุลินทรีย์ดูดไปใช้ประโยชน์ จะมีการปลดปล่อยฟอสเฟตไอออนออกจากส่วนของฟอสฟอรัสที่เปลี่ยนรูปง่ายมาทดแทน ขณะเดียวกันฟอสฟอรัสที่เปลี่ยนรูปยาก ก็ทยอยปรับเปลี่ยนมาเป็นประเภทที่เปลี่ยนรูปง่าย
ส่วนของฟอสฟอรัสในดิน ที่จะทยอยปลดปล่อยฟอสเฟตไอออนออกมาสู่สารละลายดินมี 3 รูป คือ
1) ฟอสเฟตที่ดูดซับอยู่กับผิวของอนุภาคเหล็กออกไซด์ อะลูมินัมออกไซด์และแร่ดินเหนียวบางชนิด
2) ตะกอนของสารประกอบฟอสเฟตบางส่วนที่พอจะละลายได้
3) สารอินทรีย์ฟอสเฟตบางส่วนที่โครงสร้างโมเลกุลไม่สลับซับซ้อน
7. การสูญหายของฟอสฟอรัสออกไปจากดิน
ฟอสฟอรัสในดินอาจสูญหายจากดินได้ 3 ทาง คือ
1) พืชดูดไปสะสมแล้วติดไปกับผลผลิตหรือส่วนของพืชที่เก็บเกี่ยว
2) การชะละลาย กล่าวคือเมื่อมีน้ำส่วนเกินไหลผ่านชั้นดิน น้ำจะชะเอาฟอสเฟตไอออนไป
3) การกร่อนดิน โดยติดไปกับอนุภาคดินถูกพัดพาออกไปจากพื้นที่
.................................................



